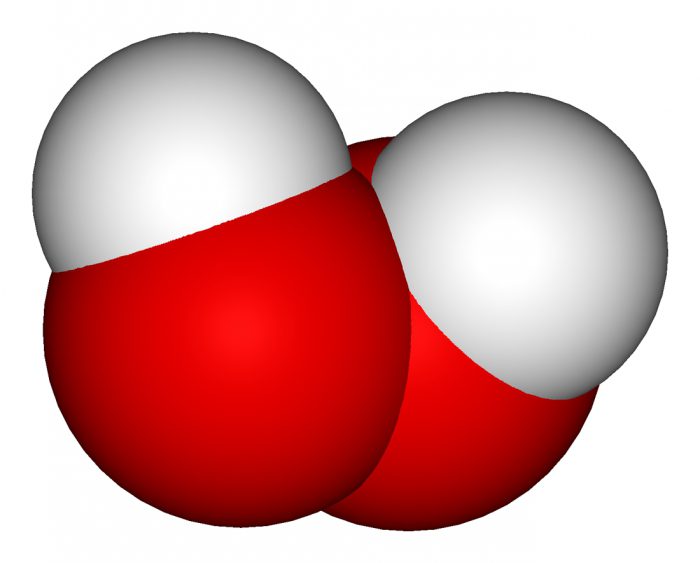
Хидриди су ... Употреба хидрида
Свако од нас је наишао на такве речиНаука, попут хемије. Понекад су тако сличне да је тешко разликовати једно од другог. Али, веома је важно да их разумијемо јер понекад ово неспоразум води у врло глупе ситуације, а понекад и до непроцењивих грешака. У овом чланку ћемо описати који су хидриди, који од њих су опасни, а који нису, где се примјењују и како се добијају. Али почињемо са кратком дигресијом у историју.

Историја
Хидриди започињу своју историју откривањем водоника. У 18. веку Хенри Цавендисх је пронашао овај елемент. Водоник, као што је познато, део је воде и представља основу свих осталих елемената периодичне таблице. Захваљујући њему могуће је постојање органских једињења и живот на нашој планети.
Осим тога, водоник је основа за многенеорганска једињења. Међу њима су киселине и алкали, као и јединствена бинарна једињења водоника са другим елементима - хидриди. Датум њихове прве синтезе није познат тачно, али су хидриди неметала познати човеку од антике. Најчешћи од њих је вода. Да, вода је хидрид кисеоника.
Ова класа укључује и амонијак (основникомпонента течног амонијака), водоник-сулфид, водоник-хлорид и слично. Више детаља о својствима супстанци из ове разноврсне и изненађујуће класе једињења биће разматране у наредном одељку.

Физичке особине
Хидриди су углавном гасови. Међутим, ако узмемо металне хидриде (они су нестабилни у нормалним условима и брзо реагују са водом), онда могу бити чврсте супстанце. Неке од њих (на пример, водоник бромид) постоје иу течном стању.
Дајте општи опис таквој огромној класисупстанце су једноставно немогуће, јер су све различите и, у зависности од елемента који је део хидрида, поред водоника, имају различите физичке карактеристике и хемијске особине. Али могу се подијелити на класу, везе у којима нешто слично. У наставку ћемо разматрати сваку класу посебно.
Јонски хидриди су једињења водоника саалкални или алкално-земни метали. То су супстанце беле боје, стабилне у нормалним условима. Када се загревају, ова једињења се распадају у метал и водоник који улазе у њихов састав без топљења. Један изузетак је ЛиХ, који се топи без разлагања и под јаким загревањем претвара у Ли и Х2.
Метални хидриди су једињења пролазнихметали. Врло често имају варијабилни састав. Они могу бити представљени као чврста раствора водоника у метал. Такође има кристалну структуру метала.
Прецизно припада ковалентним хидридимаврста која се најчешће налази на Земљи: једињења водоника са не-метали. Широк спектар ових супстанци је због њихове високе стабилности, пошто су ковалентне везе најјаче од хемијских супстанци.
Као пример, формула силицијум хидрида: СиХ4. Ако погледамо у запремини, видећемо товодик је веома густо привучен централним силицијумским атомом, а његови електрони се померају на њега. Силицијум има довољно електронегативност, тако да је у стању да привуче електроне у своје језгро, чиме скраћује дужину везе између њега и сусједног атома. И као што знате, краћа је веза, то је јача.
У следећем поглављу ћемо размотрити како се хидриди разликују од других једињења у смислу хемијске активности.

Хемијска својства
У овом одељку такође је вредно подијелити хидриде у те дијеловеисте групе као у прошлости. И почињемо са својствима јонских хидрида. Њихова главна разлика од друге две врсте је да активно комуницирају са водом како би се формирало алкало и ослобађање водоника у облику гаса. Реакција хидридне воде је прилично експлозивна, тако да се везе најчешће чувају без приступа влази. Ово се ради зато што вода, чак и у ваздуху, може покренути опасну трансформацију.
Покажимо једначину горе описане реакције коришћењем примера супстанце као што је калијум хидрид:
КХ + Х2О = КОХ + Х2
Као што видимо, све је довољно једноставно. Стога, узмите у обзир интересантније реакције које су карактеристичне за друге две врсте супстанци описане од стране нас.
У принципу, остатак трансформације, да нисмосу растављени, карактеристични су за све врсте супстанци. Они имају тенденцију да интерагују са металним оксидима како би се формирао метал, било са водом или са хидроксидом (који је карактеристичан за алкалне и земноалкалне метале).
Још једна интересантна реакција је термалнаразградња. Појављује се на високим температурама и пролази до стварања метала и водоника. Нећемо се задржати на овој реакцији, јер смо то већ анализирали у претходним одељцима.
Дакле, испитивали смо особине ове врсте бинарних једињења. Сада је вредно разговарати о томе како их добити.

Припрема хидрида
Скоро сви ковалентни хидриди су природнивеза. Они су довољно стабилни, тако да се не распадају под дејством спољних сила. Са јонским и металним хидридима, све је нешто компликованије. Они не постоје у природи, тако да их морају синтетизовати. Ово се ради веома једноставно: реакцијом интеракције водоника и елемента, од чега се захтева хидрид.
Апликација
Неки хидриди немају специфичностиали већина су веома важне супстанце за индустрију. Нећемо ући у детаље, јер су сви чули да се, на пример, амонијак користи у многим сферама и служи као незаобилазна супстанца за добијање вештачких аминокиселина и органских једињења. Употреба многих хидрида ограничена је посебностима њихових хемијских својстава. Стога се користе искључиво у лабораторијским експериментима.
Апликација - превелик део за овокласа супстанци, па смо се ограничили на опште чињенице. У следећем делу ћемо вам рећи колико од нас, без одговарајућег знања, збуњујемо безазлене (или барем познате) супстанце међу собом.

Неке заблуде
На пример, неки верују да је хидроген хидрид- нешто опасно. Ако то можете назвати тако, онда нико не ради. Ако размишљате о томе, хидроген хидрид је водонично једињење са водоником, што значи да молекул Х2. Наравно, овај гас је опасан, али само у смеши са кисеоником. У својој најчистој форми то не представља опасност.
Постоји много чудних имена. Неруклепе за човека у чему су ужаснути. Међутим, како показује пракса, већина њих није опасна и користи се за домаће потребе.
Закључак
Свет хемије је огроман, и, мислимо, ако ненакон тога, након неколико других чланака које ћете видети сами. Зато је смисла уронити себе у учење са главом. Човечанство је открио многе нове ствари и још увек је непознато. А ако вам се чини да у области хидрида нема ничег занимљивог, погрешно сте.