Амонијачка вода: припрема, формула, апликација
Безбојни гас са оштрим мирисом НХ амонијака3 не само добро се раствара у води са ослобађањем топлоте. Супстанца активно ступи у контакт са Х молекулима2О са формирањем слабе алкалије. Решење је добило неколико имена, од којих је једна - водена амонијака. Једињење има изненађујућа својства, која су на начин формирања, састава и хемијске реакције.
Формирање амонијумског јона

Амонијум јон са једним позитивнимпуњење и посебан тип слабе ковалентне везе - донор-акцептор. Према својој величини, пуњењу и неким другим карактеристикама, он подсећа на калијум катион и понаша се као алкални метали. Необично хемијски, једињење реагује са киселинама, формира соли који су од великог практичног значаја. Називи у којима се одражавају карактеристике препарата и својстава супстанце:
- амонијачна вода;
- амонијум хидроксид;
- хидрат амонијака;
- ацрид аммониум.
Предострожности
Потребно је водити рачуна о раду амонијака и његових деривата. Важно је запамтити:
- Амонијумска вода има непријатан мирис. Отпуштени гас иритира слузену површину носне шупљине, око, изазива кашаљ.
- Приликом одлагања амонијак у благо затвореној бочице, ампуле пуштен амонијак.
- Можете се детектовати без апарата, само по мирису, чак и малом количином гаса у раствору и ваздуху.
- Однос између молекула и катиона у раствору варира при различитој пХ вредности.
- У вредности од око 7, концентрација токсичног гаса НХ3, повећава се количина НХ катиона мање штетних за живе организме4+
Припрема амонијум хидроксида. Физичке особине
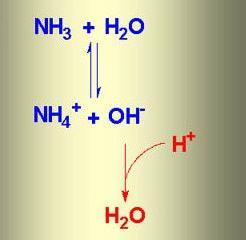
Када се амонијак раствара у води, формира се амонијак вода. Формула за ову супстанцу је НХ4ОХ, али заправо постоје истовремено јони
НХ4+, ОХ-, НХ3 и Х2О. У хемијској реакцији јонске размене између амонијака и воде утврђено је равнотежно стање. Процес се може одразити помоћу схеме у којој супротно усмерене стрелице указују на реверзибилност феномена.
У лабораторији се врши производња воде из амонијакаексперименти са супстанцама које садрже азот. При мешању амонијака са водом добија се бистра, безбојна течност. При високим притисцима, растворљивост гаса се повећава. Вода оставља више амонијака растворених у њему када се температура повећава. За индустријске потребе и пољопривреду на индустријском нивоу, 25% супстанца се добија у растварању амонијака. Друга метода подразумијева кориштење реакције коксне пећи гаса са водом.
Хемијска својства амонијум хидроксида
Када су у контакту, две течности - вода амонијакаи хлороводонична киселина - покривени су клубовима белог дима. Састоји се од честица производа реакције - амонијум хлорида. Са испарљивом материјом као што је хлороводонична киселина, реакција се јавља директно у ваздух.

Слабо алкалне хемијске особине амонијака хидрата:
- Супстанца се реверзибилно дисоцира у води како би се формирао амонијум катион и хидроксидни јон.
- У присуству НХ4+ безбојни раствор фенолфталеина претвара у црвену боју, као у алкалије.
- Хемијска реакција неутрализације са киселинама доводи до стварања соли амонијака и воде: НХ4ОХ + ХЦл = НХ4Цл + Х2О.
- Амонијачка вода улази у реакције јонске размјене са металним солима којима одговарају слабе базе, док се формира водоњестиви хидроксид: 2НХ4ОХ + ЦуЦИ2 = 2НХ4Цл + Цу (ОХ)2 (плави талог).
Вода амонијака: апликација у различитим гранама привреде
Необична супстанца се широко користи у свакодневном животу,пољопривреде, медицине, индустрије. Технички амонијак хидрат се користи у пољопривреди, производњи сода пепела, боја и других производа. У течном ђубриву, азот се налази у облику која се лако прилагођава биљем. Супстанца се сматра најјефтинијим и најефикаснијом за примјену у периоду предвиђања за све усеве.

Производња амонијака се троши у производњутри пута мање од ослобађања чврстих грануларних азотних ђубрива. За складиштење и транспорт течности користе се херметички затворени челични резервоари. Неке врсте боја и средстава за избјељивање косе се израђују помоћу каустичног амонијума. У свакој медицинској установи постоје лекови са алкохолом амонијака - 10-процентни раствор амонијака.
Амонијум соли: својства и практичан значај

Супстанце које се добијају интеракцијомамонијум хидроксид са киселинама, користе се у економским активностима. Соли распадају при загревању, растварају у води, пролазе хидролизу. Улазе у хемијске реакције са алкалијама и другим супстанцама. Најважнији практични значај стекли су хлориди, нитрати, сулфати, фосфати и амонијум карбонати.
Веома је важно поштовати правила и меребезбедност, радом са супстанцама које садрже амонијум јон. Када се чувају у складиштима индустријских и пољопривредних предузећа, на супсидијарним фармама не би требало да постоји контакт таквих једињења са кречњаком и алкалијама. Ако је слијепост пакета прекинута, хемијска реакција ће почети са ослобађањем токсичног гаса. Свако ко мора да ради са водом амонијака и његовим солима мора да познаје основе хемије. Уколико су испуњени услови за безбедност, употребљене супстанце неће штетити људе и животну средину.




