Протеини: структура протеина и функција
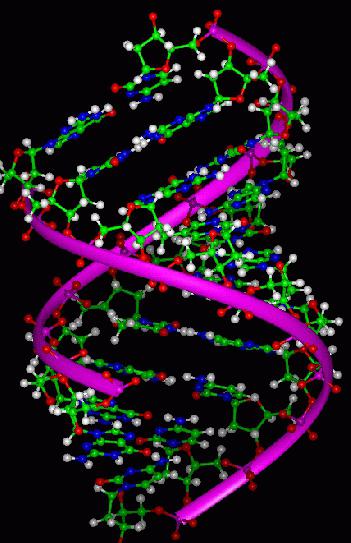
Протеини су органске супстанце. Ова високо-молекуларна једињења се одликују одређеним саставом и распадају у аминокиселине током хидролизе. Молекули протеина могу бити различитих облика, од којих су многи састављени од неколико полипептидних ланаца. Информације о структури протеина су кодиране у ДНК, а синтеза протеинских молекула се назива превод.
Хемијски састав протеина
Просечан протеин садржи:
- 52% угљеника;
- 7% водоника;
- 12% азота;
- 21% кисеоника;
- 3% сумпора.
Молекули протеина су полимери. Да би се разумела њихова структура, неопходно је сазнати који су њихови мономери - аминокиселине.
Амино киселине
Оне су подељене у две категорије: стално наступајуће и понекад се јављају. Први обухвата 18 мономера протеина и још два амида: аспарагинску и глутаминску киселину. Понекад постоје само три киселине.
Ове киселине се могу класификовати на различите начине: природом бочних ланаца или пуњења њихових радикала, а могу се подијелити и са бројем група ЦН и ЦООХ.
Примарна структура протеина
Редослед измене аминокиселина у протеинуЛанац дефинира своје накнадне нивое организације, својстава и функција. Главни тип везе између мономера је пептид. Формира се уклањањем водоника из једне аминекслоте и ОХ групе од друге.
Први ниво организације протеинског молекула -ово је секвенца аминокиселина у њему, једноставно ланац који одређује структуру протеинских молекула. Састоји се од "скелета" који има редовну структуру. Ово је понављајућа секвенца -НХ-ЦХ-ЦО-. Одвојени бочни ланци представљају амино киселински радикали (Р), њихова својства одређују састав структуре протеина.

Чак и ако је структура протеинских молекула иста, онимогу се разликовати у својствима само из чињенице да њихови мономери имају другу секвенцу у ланцу. Редослед аминокиселина у протеину одређује се геном и диктира протеин одређене биолошке функције. Секвенца мономера у молекулима одговорним за исту функцију често је у различитим врстама. Такви молекули су исти или слични у организацији и врше исте функције код различитих врста организама - хомологних протеина. Структура, својства и функције будућих молекула постављени су већ у фази синтезе ланца амино киселина.
Неке заједничке карактеристике
Структура протеина је проучавана прилично дуго времена, иАнализа примарне структуре омогућила нам је да неке генерализације. За већи број протеина карактерише присуство свих двадесет аминокиселина, од којих су многи посебно глицин, аланин, аспарагинске киселине, глутамин и мало триптофан, аргинин, метионин, хистидин. Изузеци су само неколико група протеина, као што је хистона. Они су потребни за ДНК паковања и садрже много хистидина.
Друга генерализација: у глобуларним протеинама не постоје општи обрасци у изменама амино киселина. Али чак иу биолошким полипептидима далеко од биолошке активности, постоје и мали идентични фрагменти молекула.
Секундарна структура

Други ниво организације полипептидног ланца -ово је његов просторни аранжман, који се одржава због водоничних веза. Одвојите α-хелик и β-фолд. Дио ланца нема уређену структуру, такве зоне се називају аморфним.
Алфа-спирала свих природних протеинадесно закривљени. Бочни радикали аминокиселина у вијачници су увек окренути ка споља и налазе се на супротним странама своје осовине. Ако су неполарне, оне су груписане на једној страни спирале, што резултира луковима који стварају услове за конвергенцију различитих спиралних подручја.
Бета-зглобови - снажно издужени спирали - имају тенденцију да се усагласе у молекулу протеина један поред другог и формирају паралелне и нонпараллелне β-фолд слојеве.
Терцијарна структура протеина

Трећи ниво организације протеинског молекула -преклапање спирала, преклопа и аморфних подручја у компактну структуру. Ово је због интеракције страних радикала мономера међусобно. Такве везе су подељене на неколико типова:
- водоничне везе се формирају између поларних радикала;
- хидрофобна - између неполарних Р-група;
- електростатичке силе привлачења (јонске везе) - између група чије су оптужнице супротне;
- дисулфидних мостова - између радикала цистеина.
Последњи тип везе (-С = С-) јековалентна интеракција. Дисулфидни мостови ојачавају протеине, њихова структура постаје трајнија. Али присуство таквих веза није неопходно. На пример, цистеин може бити врло мали у полипептидном ланцу, или се његови радикали налазе уз раме и не могу створити "мост".
Четврти ниво организације
Квартарна структура није формирана од стране свих протеина. Структура протеина на четвртом нивоу је одређена бројем полипептидних ланаца (протомера). Они су повезани истим везама као претходни ниво организације, изузев дисулфидних мостова. Молекула се састоји од неколико протомера, од којих свака има своју (или идентичну) терцијарну структуру.

Сви нивои организације одређују те функције,који ће извршити настале протеине. Структура протеина на првом нивоу организације веома прецизно одређује њихову накнадну улогу у ћелији и организму у цјелини.
Функције протеина
Тешко је чак замислити колико је важна улога протеина у активности ћелије. Изнад смо сматрали њихову структуру. Функције протеина директно зависе од тога.
Извођење структурне (структурне) функције, онеформирају основу цитоплазме било које ћиве ћелије. Ови полимери су главни материјал свих ћелијских мембрана када су комплексирани са липидима. Ово такође укључује поделу ћелија у одјељке, у којима се сваки од њих одвијају њихове реакције. Чињеница је да су за сваки комплекс ћелијских процеса потребни њихови услови, нарочито пХ медија игра велику улогу. Протеини граде танке преграде које подељују ћелију у такозвани одјељак. И сам феномен назива се сабирањем.
Каталитичка функција је да регулише све ћелијске реакције. Сви ензими по пореклу су једноставни или сложени протеини.
Било какав кретање организама (рад мишића,кретање протоплазме у ћелији, треперење цилија у протозојима итд.) врше протеини. Структура протеина омогућава им да се крећу, формирају влакна и прстенове.

Хормонска улога ових полимера је разумљиво одједном: о структури бројних хормона су протеини, као што су инсулин, окситоцина.
Функција Замена се одређује тако да протеини могу да формирају депозите. На пример, валгумин јаја, казеин, биљно семе резервних протеина - велики број хранљивих материја сачуваних њима.
Све тетиве, зглобне зглобове, кости скелета, копитке формирају протеини, што нас доводи до њихове следеће функције - пратећег.
Молекули протеина су рецептори, чинећи селективно препознавање одређених супстанци. У тој улоги су посебно познати гликопротеини и лектини.
Најважнији фактори имунитета су антитела и системкомплемент по поријеклу су протеини. На пример, процес коагулације крви се заснива на променама фибриногеног протеина. Унутрашњи зидови једњака и желуца су обложени заштитним слојем слузничких протеина - лизини. Токсини су такође протеини порекла. Основа коже, заштита тела животиња, је колаген. Све ове функције протеина су заштитне.

Па, последња функција је регулаторна. Постоје протеини који контролишу рад генома. То значи, они регулишу транскрипцију и превод.
Без обзира на важну улогу беланчевина, структура протеина већ дуго времена решавају научници. А сада они отварају нове начине коришћења овог знања.